5.2 Homologe Reihe der Alkohole, Alkanole
Vgl. AB
Vervollständige die Tabelle:
| Name | Strukturformel | Summenformel | Schmelztemp. | Siedetemp. | Aggregatzustand |
Löslichkeit in Wasser |
Löslichkeit in Benzin |
| Methanol | - 96,9 °C | 64,5 °C | flüssig | ||||
| - 114,1 °C | 78,5 °C | flüssig | |||||
| - 126,5°C | 97,4 °C | flüssig | |||||
| - 89,5 °C | 117,3 °C | flüssig | |||||
| - 79,0 °C | 137,3 °C | flüssig | |||||
| ... | ... | ... | ... | ... | ... | ||
| Hexadecanol | 50,0 °C | 334,0 °C | fest |
{slider title="Lösung" open="false" class="icon"}
{/sliders}
5.2.1 Alkohole bestehen aus zwei verschiedenen Gruppen:
Hydroxygruppe (früher Hydroxyl-Gruppe):
Sowohl vom positivierten Wasserstoff als auch vom negativierten Sauerstoff können Wasserstoffbrücken ausgehen (Hydrophiler Rest).
b) Alkylgruppe (bspw. "Methyl"):
Hier liegt kein positivierter Wasserstoff vor, es können sich keine Wasserstoffbrücken ausbilden (Hydrophober Rest).
5.2.2 Einige wichtige Alkohole
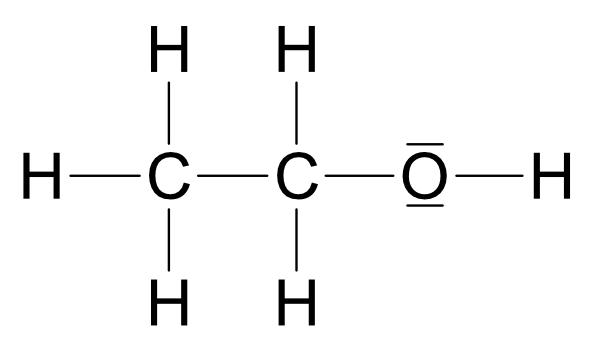
a) Methanol (Methylalkohol, „Holzgeist“): CH₃OH
Sdp.: + 65°C
Herstellung: Aus Methangas
Verwendung:
- Zur Synthese in der chemischen Industrie
- Frostschutzmittel
Nachweis: Grüne Flamme von Trimethylborat LE
b) Ethanol (Ethylalkohol, „Weingeist“): C₂H₅OH
Sdp.: + 78°C
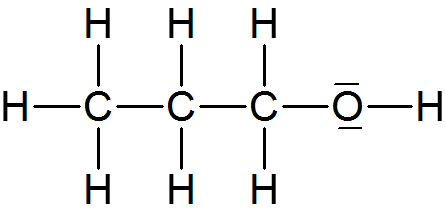
c) Propanol (Propylalkohol) C₃H₇OH
- 1-Propanol oder n-Propanol
Sdp.: 97°C
- 2-Propanol oder Isopropanol
Sdp.: +82°C
Verwendung: u.a. Lösungsmittel
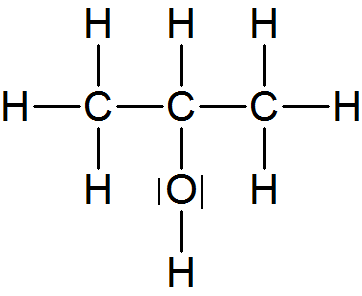
d) Butanol (Butylalkohol);C₄H₉OH
Es gibt vier isomere Verbindungen:
AA: zeichnet alle 4 Isomere und beschriftet sie nach der Genfer Nomenklatur
{slider title="Lösung" open="false" class="icon"}
I) 1-Butanol = Butan-1-ol: Sdp.: + 117°C
II) 2-Butanol: Sdp.: + 100°C
III) 2-Methyl-2-propanol = 2-Methyl-Propan-2-ol: + 83°C
IV) 2-Metyhl-1-propanol: + 108°C
{/sliders}
5.2.3 Löslichkeit von primären und unverzweigten Alkoholen
| Löslichkeit von... | in Wasser | in Benzin |
| Methanol | gut | wenig |
| Ethanol | gut | gut |
| 1-Propanol | gut | gut |
| 1-Butanol | wenig | gut |
| 1-Pentanol | wenig | gut |
Versuchsskizze: Methanol + Benzin
Merke: Je länger das Alkoholmolekül, desto ähnlicher den Alkanen (unähnlicher dem Wasser).
Allgemein gilt: „Ähnliches löst sich in Ähnlichem“
Niedere (kurzkettigere) Alkohole können Solvathüllen bilden deshalb Salze lösen (jedoch schlechter als Wasser!). Es gibt sogar feste Salze mit „Kristallalkohol“. (analog: Salze mit Hydratwasser).