2.6 Konzentrationszelle
Experiment:
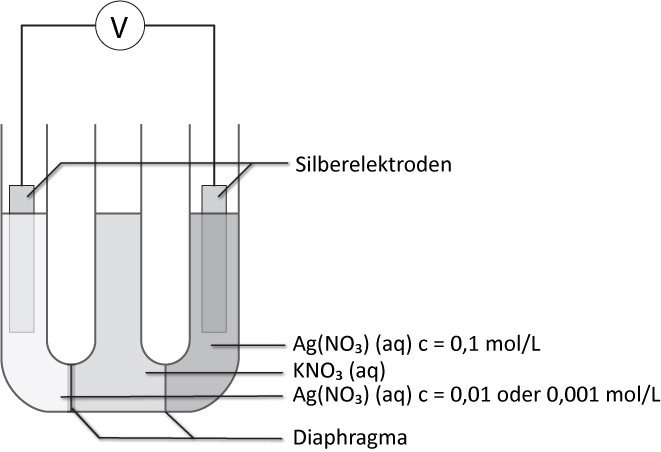
Kombiniert man zwei gleichartige Halbzellen, bei denen nur die Konzentrationen der Elektrolytlösungen verschieden sind, zu einem galvanischen Element, so besteht allein aufgrund dieses Konzentrationsunterschiedes eine Spannung zwischen den Halbelementen.
Silberkonzentrationszelle:
Ag / Ag¹⁺(c = 0,01 mol/L) // Ag¹⁺(c = 0,1 mol/L) / Ag
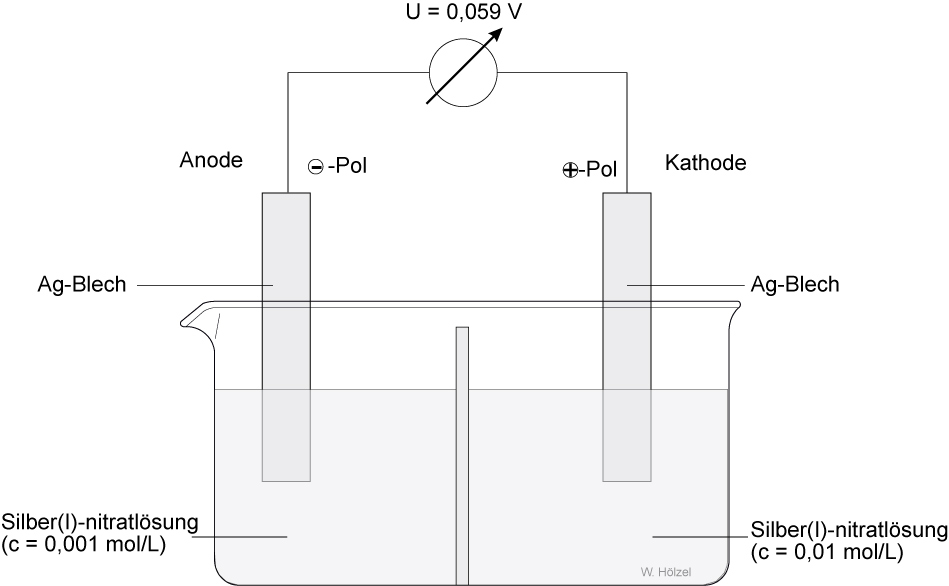
Die Halbzelle mit der geringer konzentrierten Elektrolytlösung ist die Donatorhalbzelle (Minuspol). Das lässt sich nur so erklären, dass bis zur Einstellung des elektrochemischen Gleichgewichts in der Halbzelle mit dem stärker verdünnten Elektrolyten mehr Ionen aus dem Metall in die flüssige Phase übertreten sind als in der anderen Halbzelle.
Werden beide Halbzelle leitend verbunden, so werden in der Donatorhalbzelle Ag-Atome oxidiert und in der Akzeptorhalbzelle Ag¹⁺-Ionen als festes Ag abgeschieden.
Wichtig: Der Stromfluss endet, wenn beiden Halbzellen gleiche Konzentrationen entstanden sind.
