2 Gleichgewichte
2.1 Schwefelsäure – Wasserdampf – Gleichgewicht
a) konzentrierte Schwefelsäure (H2SO4)
- enthält Schwefelsäuremoleküle
- zeichnet einmal die Strukturformel(n) (unter Berücksichtigung, dass die Edelgas-Regel erfüllt sein muss):
{slider title="Lösung" open="false" class="icon"}
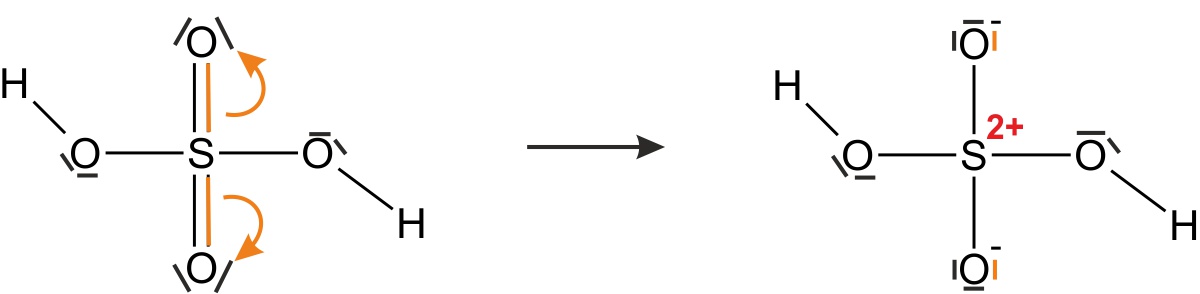
{/sliders}
- Konzentrierte Schwefelsäure ist geruchlos;
- Siedetemperatur beträgt 300°C;
- Konzentrierte Schwefelsäure reagiert heftig mit Wasser und Ionenbildung (Protolyse-Reaktion)
Formuliert für die Reaktion der Schwefelsäure mit Wasser in zwei Stufen die Reaktionsgleichung in Summenformeln
{slider title="Lösung" open="false" class="icon"}
H2SO4 + H2O → HSO4- + H3O+
HSO4- + H2O → SO42- + H3O+
{/sliders}
b) Verdünnte Schwefelsäure
Verdünnte Schwefelsäure enthält folgende Ionen und Moleküle; nennt diese:
{slider title="Lösung" open="false" class="icon"}
- H3O+ (Oxonium-Ion; früher Hydronium-Ion oder „Hydroxonium-Ion“)
- HSO4- (Hydrogensulft-Ion)
- SO42- (Sulfat-Ion; wenig)
- H2O Enthält viele Wassermoleküle
{/sliders}
2.2 Langzeitversuch: Konzentrierte Schwefelsäure
Versuchsdurchführung: In einen Zylinder 1 werden 100 ml konzentrierte Schwefelsäure gegeben. In einen Zylinder 2 werden zunächst 900 ml Wasser und dann vorsichtig 100 ml konzentrierte Schwefelsäure gegeben. Beide Zylinder werden mehrere Jahre offen im gleichen Zimmer stehengelassen.
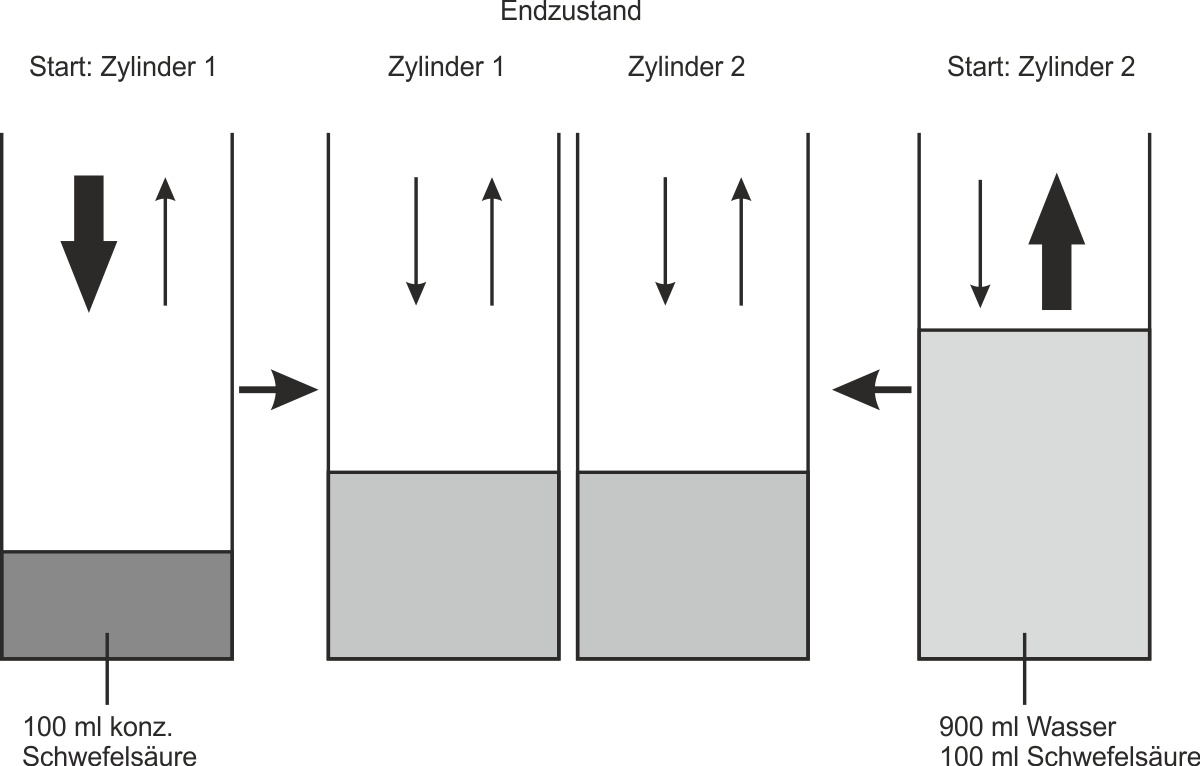
Versucht eine Deutung dieses Versuches:
{slider title="Lösung" open="false" class="icon"}
• Zylinder 1 nimmt mehr H2O -Moleküle aus der Umgebung auf als er abgibt.
• Zylinder 2 gibt mehr H2O -Moleküle an die Umgebung ab, als er aufnimmt.
• Nach einigen Jahren hat sich ein Gleichgewichtszustand eingestellt: Pro Zeiteinheit werden nun gleich viel H2O-Moleküle an die Umgebung abgegeben wie H2O-Moleküle in die Lösung hinzukommen.
{/sliders}
