4.7.5 Sauerstoff-Korrosion – Rosten von Eisen
Durch Ausbildung von Lokalelementen kann Eisen auch in neutralen und alkalischen Lösungen zerstört werden (rosten).
Eine wichtige Rolle spielt der im Wasser gelöste Sauerstoff.
Edlere Fremdmetalle im Eisen oder auch Eisenoxid dient als Kathode.
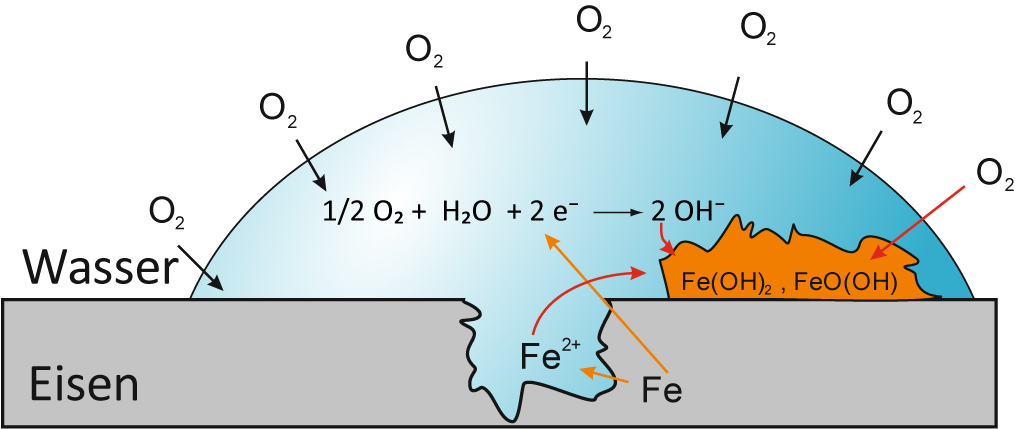
Es laufen nun beim „Rosten“ folgende Reaktionen ab.
{slider title="Lösung" open="false" class="icon"}
Anode: 2 Fe → 2 Fe²⁺ + 4 e⁻
Kathode: O₂ + 2 H₂O + 4 e⁻ → 4 OH⁻
{/sliders}
Die Hydroxid-Ionen bilden sich bevorzugt in sauerstoffreichen Zonen des Wassers; die Eisen(II)-Ionen bilden sich dagegen in sauerstoffärmeren Bereichen.
Treffen nun die Eisen(II)-Ionen und die Hydroxid-Ionen aufeinander, so entsteht schwerlösliches Eisen(II)-hydroxid:
{slider title="Lösung" open="false" class="icon"}
Fe²⁺ + 2 OH⁻ → Fe(OH)₂
{/sliders}
Luftsauerstoff bewirkt dann die Bildung einer porösen Rostschicht.
4 Fe(OH)₂ + O₂ → 4 FeO(OH) + 2 H₂O
“Rost”
